2020年9月25日,生物自噬领域权威期刊《Autophagy》(《自噬》)杂志在线发表了我校生物工程与食品学院、国家细胞调控与分子药物“111”引智基地、发酵工程教育部重点实验室唐景峰/陈兴珍课题组在生物细胞自噬方面的最新研究成果。论文题目为“TSPAN1 promotes autophagy flux and mediates cooperation between WNT-CTNNB1 signaling and autophagy via the MIR454-FAM83A-TSPAN1 axis in pancreatic cancer”(链接:)。我校为第一署名单位,唐景峰教授为通讯作者。生物工程与食品学院教师周策凡博士为第一作者,唐景峰教授的硕士研究生梁燕燕为共同第一作者。该研究得到国家自然科学基金(31871420; 31701228和31871176.)、湖北省杰出青年基金(2020CFA073)及武汉市基础前沿项目(2019020701011475)资助。

自噬是一种进化上非常保守的溶酶体介导的生物降解过程,对细胞内稳态具有重要的调控作用。自噬后期进程中自噬体与溶酶体的融合是极其复杂的。到目前为止,已经确定了许多因子参与该过程的膜融合,如细胞骨架成分、SNARE复合物、HOPS复合物、RA7等,它们都是确保自噬体与溶酶体精确且有效融合的重要成分。近年来,越来越多新的蛋白因子被报道参与该过程,这些新的发现为自噬的发生机制及精确调控提供了重要的理论基础。
TSPAN1属于四聚体蛋白(Tetraspanins, TSPAN),由一组异质适配体蛋白组成,以富含TSPAN的结构域形式存在。其被报道与胰腺癌、胃癌、前列腺癌、骨肉瘤密切相关,但其作用机制尚不清楚。本研究中该团队利用细胞模型和斑马鱼模型首次发现并验证了TSPAN1在自噬后期自噬体与溶酶体的融合过程发挥重要的调控作用。通过后期相互作用蛋白的筛选,他们发现并验证了TSPAN1与自噬后期融合相关蛋白LC3、SNARE复合体及HOPS复合体等均存在相互作用。并进一步阐明了TSPAN1蛋白中存在的2个特异性的LIR(LC3 Interacting Region)结构域。将以上2个位点突变后能够使得TSPAN1对胰腺癌的生长进程减弱甚至消失。
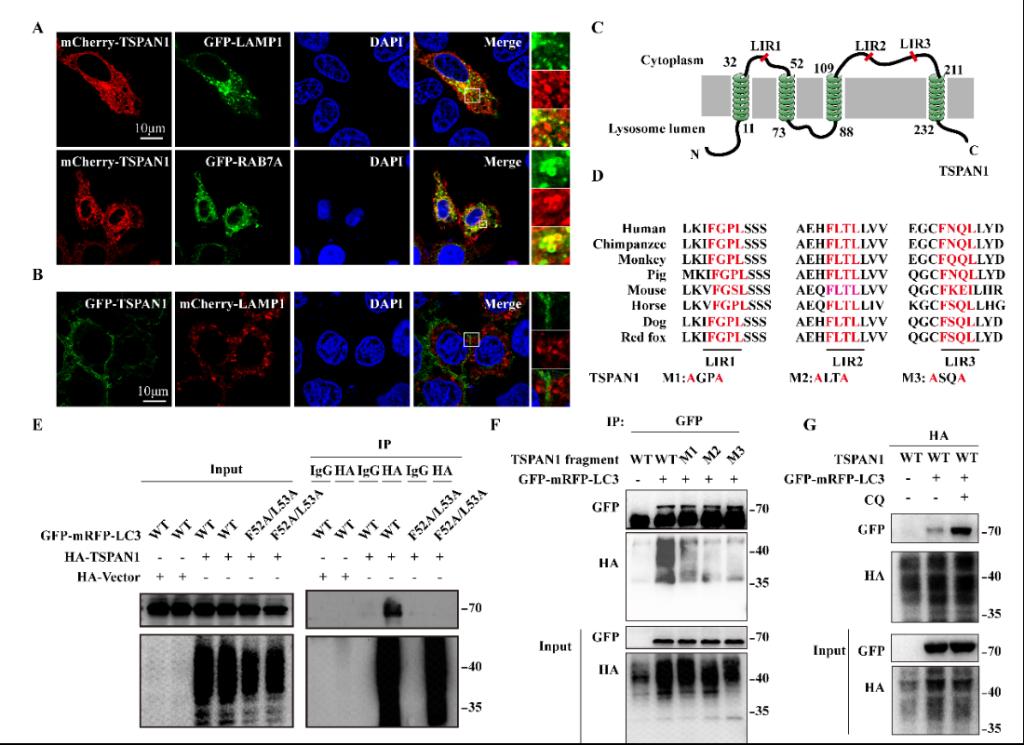
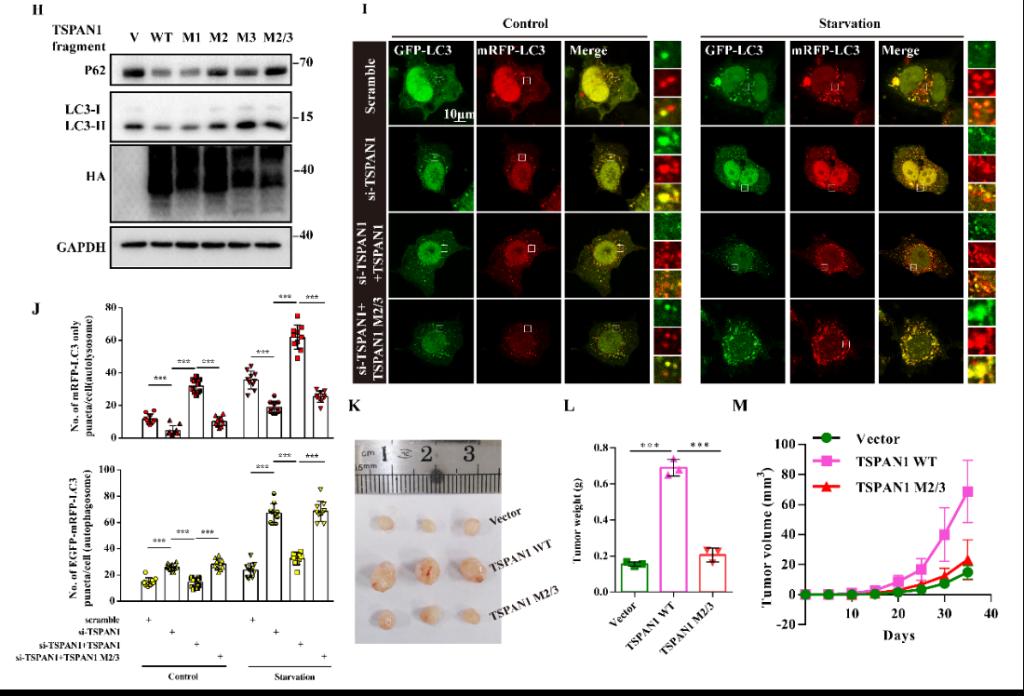
图1.TSPAN1 与LC3的LIRs区结合促进自噬。(A、B)TSPAN1与RAB7标记的内涵体和溶酶体具有共定位作用;(C)TSPAN1蛋白结构示意图;(D)TSPAN1与LC3相互作用的LIR基序示意图;(E)将LC3蛋白中与LIR相互作用具有关键作用的F52/L53突变成A后,其与TSPAN1蛋白的相互作用消失;(F)将TSPAN1蛋白LIR基序突变后,其与LC3的相互作用明显减弱;(G)利用CQ抑制自噬体和溶酶体的融合后,TSPAN1和LC3的相互作用增强;(H)TSPAN1不同突变体对自噬的影响;(I、J)TSPAN1干扰后能够显著抑制自噬流,而过表达TSPAN1野生型后能够回复TSPAN1对自噬的调控作用,而过表达TSPAN1突变型则不能;(K-M)TSPAN1能够促进裸鼠内肿瘤的大小。
细胞内Wnt/β-catenin信号通路与自噬活动密切相关。对于胰腺癌细胞而言,其细胞内存在高度激活的Wnt信号和高水平的自噬活动,而协同作用的具体分子机制还是未知的。该项研究还发现并阐明了胰腺癌细胞内MIR454能够靶向作用于TSPAN1以及Wnt调控蛋白FAM83A的3'UTR,进而调控TSPAN1和FAM83A的表达。同时还发现Wnt/β-catenin中β-catenin-TCF4转录复合体能够结合到TSPAN1启动子区TCF/LEF基序(位于TSS前-563至-569和-609至-615)上,进而促进TSPAN1蛋白的表达。通过裸鼠皮下成瘤实验进一步验证了MIR454/FAM83A/TSPAN1轴能够协同促进胰腺癌的发生进程。
该研究不仅深化了科研人员对自噬与Wnt/β-catenin信号通路交互作用的理解,也为胰腺癌的靶向治疗及创新药物的研发提供了新的理论依据。